Efecto de extractos de ricino (Ricinus communis L.) y de Trichoderma harzianum Rifai sobre el crecimiento y desarrollo de Botrytis cinerea Whetzel y Penicillium Link, patógenos del cultivo de frutilla (Fragaria x ananassa Duch.)
Resumen
Efecto de extractos de ricino (Ricinus communis L.) y de Trichoderma harzianum Rifai sobre el crecimiento y desarrollo de Botrytis cinerea Whetzel y Penicillium Link, patógenos del cultivo de frutilla (Fragaria x ananassa Duch.)
Effect of ricino extracts (Ricinus communis L.) and Trichoderma harzianum Rifa ion the growth and development of Botrytis cinerea Whetzel and Penicillium Link pathogens of strawberry crop (Fragaria x ananassa Duch)
Cristian Belesansky1, Nicolás M. Gutiérrez2, María Cristina Sandoval3
cristian.belesansky@hotmail.com, nicolas.m.gutierrez@hotmail.com, mariacristinasandoval2@gmail.com
1Becario CIN. 2Cátedra de Microbiología 3Cátedra de Fitopatología. Facultad de Ciencias Agrarias. UNLZ
Recibido 15/01/2021; Aceptado: 17/04/2021
Resumen: La utilización indiscriminada de productos químicos para el manejo de plagas y enfermedades en la producción agrícola, ha generado problemas en la salud de los consumidores y productores y también desequilibrios ambientales. El desarrollo y la utilización de insumos biológicos para el manejo de problemas fitosanitarios revisten sumo interés a la hora de pensar en una producción de alimentos sostenible en el tiempo. Tal es el caso del cultivo de frutilla (Fragaria x ananassa Duchesne) donde se utilizan productos químicos para el control de plagas y enfermedades. En este contexto, es necesaria la investigación científica para el descubrimiento, puesta en valor y desarrollo de nuevas alternativas al control químico. En virtud de lo cual, el siguiente trabajo se propuso la utilización de Trichoderma harzianum y de diferentes extractos de semillas de ricino (Ricinus communis L.), como controladores de Botrytis cinerea y Penicillium, hongos patógenos del cultivo de frutilla. El objetivo del estudio consistió en evaluar el efecto que genera la utilización de cepas de Trichoderma harzianum, extractos hidrosolubles de semillas de ricino y aceite de ricino en el crecimiento y desarrollo de B. cinerea y Penicillium. Para lo cual se obtuvieron tres extractos hidrosolubles de semillas de ricino. Con los extractos así obtenidos y un aislamiento de Trichoderma se realizaron pruebas in vitro tendientes a determinar el efecto del aceite de ricino sobre el crecimiento de colonias de Botrytis, y del extracto de ricino y Trichoderma sobre Penicillium. Los resultados alcanzados mostraron que, de manera contraria a lo esperado, el aceite de ricino estimuló el crecimiento de Botrytis en relación directa con el aumento de la concentración. Por otra parte, los extractos de ricino y Trichoderma mostraron su efectividad en la reducción de las colonias de Penicillium 87 y55%, respectivamente.
Palabras-clave: Ricinus communis; Trichoderma; bioinsumo; biocontrol; salud ambiental.
Abstract: The development and use of biological inputs for the management of phytosanitary problems are of great interest when thinking about sustainable food production over time. The objective of the study was to evaluate the effect generated by the use of Trichoderma harzianum strains, water-soluble castor bean extracts and castor oil on the growth and development of Botrytis cinerea and Penicillium. For which three water-soluble extracts of castor seeds were obtained. With the extracts obtained and an isolation of Trichoderma, in vitro tests were carried out to determine the effect of castor oil on the growth of Botrytis colonies, and of castor extract and Trichoderma on Penicillium. The results achieved showed that castor oil stimulated the growth of Botrytis in direct relation to the increase in concentration. On the other hand, castor extracts and Trichoderma showed their effectiveness in reducing Penicillium colonies 87 and 55%, respectively.
Keywords: Ricinus communis, Trichoderma, bioinsume, biocontrol, environmental health.
1. Introducción
El cultivo de frutilla es afectado por distintas enfermedades que inciden negativamente en la longevidad de la planta, el rendimiento y la calidad de la fruta. Dentro de estas patologías se pueden reconocer: aquellas que son frecuentes y causan daños importantes en las plantaciones; las ocasionales y que bajo condiciones excepcionales causan daños a las plantas; y las enfermedades de poscosecha (Undurruga y Vargas, 2013). Las pérdidas económicas que causan las enfermedades de poscosecha constituyen uno de los principales problemas de la actividad frutihortícola mundial (Murray et al., 2019). Estas enfermedades son causadas por hongos de los géneros Penicillium, Botrytis, Alternaria y Monilinia, entre otros, que pueden invadir los frutos (Murillo et al, 2016). La frutilla es susceptible a esta invasión debido a que posee una epidermis turgente y una elevada tasa de respiración (Fraire Cordero et al., 2003).
En relación al manejo de hongos en poscosecha, el uso de fungicidas químicos de síntesis se encuentra bajo observación debido a los efectos cancerígenos, teratogénicos, a la contaminación ambiental derivada de su uso y a otros efectos negativos para la salud de los consumidores (Tripathi y Shukla, 2007). La búsqueda de alternativas de bajo impacto ambiental para esta problemática incluye numerosas investigaciones con distintos microorganismos antagónicos, utilización de bioproductos y combinación con otros tratamientos. En tal sentido, en frutilla pueden mencionarse los resultados mostrados para el control de Botrytis durante el desarrollo del cultivo y del fruto poscosecha con Gliocladium roseum (Chaves y Wang, 2004) y con Trichoderma (Murray et al., 2019); y para Penicillium expansum con Trichoderma (Drobyet al., 2009).
Entre los bioproductos, el uso de aceites esenciales para el control de enfermedades en poscosecha está recibiendo una creciente atención debido a sus características de seguridad y biodegradabilidad. Se reconoce que algunos aceites esenciales tienen propiedades antivirales, antifúngicas, antiparasitarias e insecticidas (Sivakumar y Bautista Baños, 2014). El aceite de ricino o castor (Ricinus communis L.), es un aceite comercial de uso industrial que se obtiene a partir de las semillas de dicha planta, las cuales contienen entre 35/46-53% de aceite (Correa Salgado, 2014; Pita et al. 2004, Rodríguez Arias, 2010). El aceite de castor tiene una alta demanda en el mercado actualmente, debido a que posee muy buenas características químicas que hacen que pueda ser utilizado en la elaboración de diferentes productos en las industrias farmacéuticas, de pintura, entre otras. Este aceite posee características muy diferentes a las de los aceites considerados “commodities” como los de soja y girasol y se destina exclusivamente a aplicaciones industriales, ya que no es apto para uso alimenticio humano o animal. Una de sus características particulares es que está conformado por casi un 90% de un único ácido graso llamado ricinoleico, por lo tanto, desde un punto de vista de su composición acídica, es el aceite que naturalmente presenta mayor grado de pureza química. Esta propiedad resulta particularmente valiosa para la industria química y farmacológica que basa sus procesos en la transformación del ácido ricinoleico en otros compuestos de mayor valor (De La Fuente et al., 2013). El aceite se utiliza en la fabricación de pinturas, jabones, barnices, productos de cosmética y lubricantes, entre otros (Pita et al., 2004). Además, tiene alta demanda en el mercado actual ya que es considerado como una alternativa para las energías renovables como la producción del biodiesel (Castañeda Lopez y Contreras Montejo). El mayor productor de ricino es India, seguido por China y Brasil. La extracción de una tonelada de aceite genera 1,2 toneladas de residuos, denominados “torta”. Tanto la torta como las cáscaras pueden ser usadas como fertilizantes orgánicos y como una alternativa alimenticia para rumiantes, por su alto valor proteico. Sin embargo, existen casos de envenenamiento en animales por la ingestión de la torta, por lo que es necesario un tratamiento químico o térmico (Gomes Raffagnato et al., 2019). Esto es debido a que la torta posee en su composición ricina, ricinina y otras proteínas como las globulinas, las prolaminas y las gluteninas. La ricina es una proteína tóxica de 64kD soluble en agua y de alta toxicidad para humanos, animales e insectos. Consta de dos cadenas polipeptídicas: una con propiedades de lectina, que le permite fijarse a glicolípidos y glicoproteínas presentes en la superficie de la membrana celular, y otra capaz de inhibir la síntesis de proteínas a nivel de los ribosomas (Pita et al., 2004). El contenido de ricina por semilla es variable, pero se estima que se encuentra entre un 1-5%. (Audi et al., 2005; Schieltz et al., 2010; Gomes Raffagnato et al., 2019). La ricinina es un alcaloide, con formula C8H8N202, que tiene efectos sobre el sistema nervioso central (Correa Salgado, 2014).
Distintos estudios mostraron los efectos positivos del uso de extractos de ricino como insecticida sobre diferentes especies animales como la hormiga negra común (Acromyrmex lundi) (Caffarini et al., 2008), la polilla de las harinas (Plodia interpunctella) (Colavino et al., 2006) y el picudo del agave (Scyphophorus acupunctatus) (Pacheco Sánchez et al., 2009), entre otros y también como nematicida sobre el nemátodo barrenador (Radhopolus similis) (Arboleda et al., 2012). Mientras que, existen escasas menciones acerca de su utilización para el manejo de hongos fitopátogenos. En tal sentido, pueden mencionarse la utilización del extracto de ricino para retrasar el desarrollo del tizón tardío (Phytopthora infestans), la incorporación de la planta entera al suelo para el control de Rhizoctonia solani en almácigos, y de Colletotrichum coccodes en cultivo de papa; y de un biopreparado a base de plantas de ricino, madero negro (Gliricidia sepium) y papaya (Carica papaya) para el combate de la roya Hemileia vastratixen café (Ramos Jaramillo, 2015).
Con estos antecedentes, se desarrolló el presente trabajo de carácter preliminar, tendiente a evaluar el nivel de actividad del aceite y del extracto de ricino sobre el crecimiento y desarrollo de hongos patógenos que afectan el cultivo de frutilla (principalmente en poscosecha) y comparar dicho nivel con el efecto de un aislamiento de Trichoderma.
2. Materiales y Métodos
Aceite de ricino
Se utilizó un aceite de ricino comercial procedente de India, obtenido a partir de plantas cultivadas a campo. El método de extracción de este aceite fue por prensado en frío con posterior filtrado con papel para mantener todas las cualidades del aceite crudo.
Extractos de ricino
Los extractos de ricino se obtuvieron a partir de semillas cosechadas en diferentes momentos, entre los años 2019 y 2020, de plantas de ricino de crecimiento espontáneo ubicadas en la vía pública en diferentes puntos del Área Metropolitana de Buenos Aires, Argentina; principalmente en la Ciudad de Buenos Aires y en los municipios de Avellaneda, Lanús y Lomas de Zamora, pertenecientes a la provincia de Buenos Aires. La preparación de las muestras, soluciones y los diferentes tratamientos se llevaron a cabo en el Laboratorio de Química de la Facultad de Ciencias Agrarias de la Universidad Nacional de Lomas de Zamora, sito en Kilómetro 2 Ruta Provincial N° 4 (ex Camino de Cintura), Lomas de Zamora, Provincia de Buenos Aires, Argentina.
Dado que la toxicidad del ricino se debe mayoritariamente a la presencia de ricina (Pita et al., 2004), para la extracción de la misma se adaptó el protocolo de extracción de la ricina, elaborado por Harry L. Craig, Otto H. Alderks, Sally H. Diecke y Charlotte L. Karel, patentado el 23 de octubre de 1962. Con respecto al protocolo original, se acotó el proceso de purificación para evitar trabajar con sustancias en estado sólido ya que estas presentarían un mayor riesgo para el operario. De todas formas, cabe aclarar que en todo momento se cumplieron con las normas de higiene y seguridad en el laboratorio y se trabajó con los elementos de protección personal, como guantes, barbijos, lentes, entre otros.
Obtención del extracto
El primer paso consistió en la obtención de la muestra inicial, para lo cual se utilizó una prensa de fabricación propia, basada en una estructura de hierro y un gato hidráulico o cricket (Figura 1), cuyo objetivo fue moler y extraer la mayor cantidad posible de aceite de las semillas de ricino. Una vez prensadas las semillas, el material resultante se pesó y se utilizó como muestra inicial (Figura 2).

Figura 1. Prensa para la extracción del aceite de las semillas de ricino.

Figura 2. Material resultante tras prensar las semillas.
A continuación, se preparó una solución extractante acuosa a pH 3,8 ± 0,1 acidificada con ácido sulfúrico. Además, Se preparó una solución de sulfato de sodio (Na2SO4) de 16,7% que se llevó a pH 7 utilizando una solución de carbonato de sodio (Na2CO3). Finalmente se prepararon tres soluciones (Ricino I, Ricino II y Ricino III), según se describe a continuación:
Ricino I: Se pesaron 10,004 g de muestra inicial y se disolvieron en 100 ml de agua destilada a pH 3,8. Se incubó en un agitador magnético por 20 minutos (Figura 3) y luego se realizó un filtrado de dos etapas. El primer filtrado fue a través de algodón, para clarificar la muestra. El segundo filtrado fue por medio de un papel de filtro Whatman grado 41. Al filtrado obtenido se le agregó 100 ml de la solución de Na2SO4, se agitó manualmente y la solución resultante se dejó reposar por aproximadamente dos horas. Transcurrido el tiempo, se filtró el material suspendido con un papel de filtro Whatman grado 40. El retenido se resuspendió en 50 ml de agua destilada a pH 3,8.

Figura 3. Solución en el agitador mecánico.
Ricino II: Se pesaron 10,001 g de muestra inicial y se disolvieron en 100 ml de agua destilada a pH 3,8. Se utilizó el mismo proceso de filtrado descrito para ricino I. Al filtrado obtenido se le agregó 50 ml de Na2SO4, 50 ml de acetona y se agitó manualmente. Luego se filtró el material suspendido con un papel de filtro Whatman grado 40. Al retenido se le volvió a incorporar 50 ml de Na2SO4 y 50 ml de acetona, y se agitó manualmente. Posteriormente se filtró nuevamente el material suspendido con un papel de filtro Whatman grado 40; el retenido se resuspendió en 50 ml de agua destilada a pH 3,8 y finalmente se burbujeó con N2 hasta completa evaporación del solvente.
Ricino III: Se pesaron 5013 g de muestra inicial y se disolvieron en 50 ml de agua destilada a pH 3,8. Se incubó en un agitador mecánico por 20 minutos y luego se realizó solo un filtrado a través de algodón. Las soluciones obtenidas se conservaron en frascos color caramelo a 4ºC (Figura 4) hasta el momento de realización de las pruebas.

Figura 4. Soluciones obtenidas a partir de la muestra inicial según tres tres procedimientos
Trichoderma: Se utilizó un aislamiento de Trichoderma harzianum, procedente de suelo de cultivo de frutilla aislado a través de la técnica de suelo diluido y conservado en agar papa glucosado (APG) al 2% por repiques periódicos a tubos conteniendo medio fresco.
Hongos patógenos: Botrytis cinerea y Penicillium sp., para su aislamiento se partió de la siembra de explantos de frutos infectados con síntomas de podredumbre (Figura 5). Estos explantos fueron desinfectados con hipoclorito de sodio al 2%, durante tres minutos, enjuagados con agua destilada estéril y sembrados en placa con medio agar APG al 2%. Luego del periodo de incubación (8 días a 21ºC) se procedió a la observación e identificación de las colonias desarrolladas. A partir de las colonias con características distintivas de B. cinerea y de Penicillum sp. se obtuvieron cultivos puros sembrados en placas con APG utilizando la técnica de “punta de hifa”. El inóculo necesario para las pruebas consistió en secciones de micelio, en el caso de Penicillium, y de esclerocios de B. cinerea retirados del medio de cultivo y conservados en placas estériles. Los hongos citados se incluyen en la clasificación de hongos de poscosecha dadas las pérdidas que su presencia significa (Fraire Cordero et al., 2003). Sin embargo, pueden afectar el cultivo en todas las etapas de su desarrollo y, en ocasiones permanecen quiescentes hasta la madurez y cosecha de los frutos (Morales, 2017).

Figura 5. Fruto con síntomas de podredumbre y desarrollo micelial
Pruebas de inhibición in vitro
Aceite de ricino: A partir del aceite puro, se obtuvieron diluciones del mismo, utilizando como diluyente medio APG. Se obtuvieron 3 diluciones con distinta concentración (dosis) del aceite: 250, 300 y 350 ppm. Una vez determinado el volumen del aceite para cada concentración (26,1 µl, 31.3 µl y 36.5µl respectivamente) se vertió, utilizando una micropipeta y/o un ansa calibrada, el aceite en frascos Erlenmeyer de 500 ml conteniendo 100 ml de APG enfriado a 37⁰C. Luego se procedió a verter el medio + el aceite en placas de Petri estériles. Finalmente se procedió a sembrar en el centro de las placas un esclerocio de B. cinerea.
Extracto de ricino: Con cada uno de los extractos de ricino Ricino I, Ricino II y Ricino III se prepararon diluciones por separado con 0,5 ml en 4,5 ml de APG, que se depositaron en placas de Petri. Las placas fueron sembradas, por separado, con esclerocios de B. cinerea y una sección de agar conteniendo micelio y conidios de Penicillium.
Prueba de antagonismo con Trichoderma
La prueba fue realizada utilizando la técnica del cultivo dual, para lo cual se sembraron en el centro de cajas de Petri con medio APG 2% una sección de 0,5 cm de un cultivo puro de Penicillium, enfrentada a una sección de igual tamaño del aislamiento de T. harzianum, con una distancia entre ambos de 4 cm.
Para cada combinación concentración-patógeno se sembraron tres placas e igual cantidad de placas hicieron las veces de testigo. Las placas sembradas se incubaron durante siete días a temperatura ambiente. Durante este periodo se procedió a la medición del diámetro de las colonias, con intervalos de 24 horas. El porcentaje de inhibición fue calculado utilizando la fórmula indicada por Fakhrunnisa et al. (2006).
Donde I = Porcentaje de inhibición en el diámetro de la colonia
R1 = Crecimiento radial del patógeno en la placa testigo (siembra individual)
R2 = Crecimiento radial del patógeno en las placas + aceite o extracto de ricino respectivamente.
Los datos fueron analizados a través de un análisis de la varianza utilizando el programa InfoStat (Di Rienzo et al., 2014).
3. Resultados y Discusión
Aceite de ricino. En la totalidad de las placas a las que se adicionó aceite de ricino pudo observarse el crecimiento y proliferación de esclerocios, observándose, además que a mayor concentración del aceite en el medio de cultivo fue mayor la cantidad de esclerocios de B. cinerea desarrollados. Por consiguiente, el aceite de ricino estimuló el crecimiento del patógeno (Figuras 6 y 7).
 Figura 6. Desarrollo de esclerocios en concentraciones de 250 ppm (A) y 300 (B) ppm luego de la incubación.
Figura 6. Desarrollo de esclerocios en concentraciones de 250 ppm (A) y 300 (B) ppm luego de la incubación.
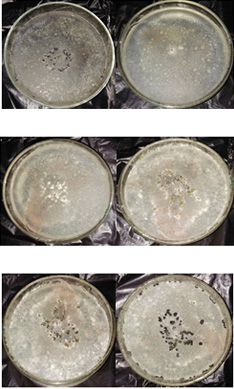
Figura 7. Evolución de la formación de esclerocios en placas adicionadas con la concentración de 350 ppm.
El efecto de estimulación del crecimiento de B. cinerea causado por el aceite de ricino, y su consiguiente efecto nulo sobre el patógeno, podría deberse a la total eliminación de los compuestos tóxicos que estaban presentes en las semillas, del aceite. El proceso industrial por el que se extrajo el aceite de ricino fue el prensado en frio, y al ser la ricina una proteína hidrosoluble, esta no se extrae conjuntamente con el aceite, resultando el aceite de ricino un producto seguro (Worbs et al., 2011). Por lo tanto, las sustancias con actividad biológica no estarían presentes en el aceite. Toda vez que, el control de hongos fitopatógenos se ha logrado con la utilización de extractos, incorporación al suelo de la planta completa o biopreparados, procesos que no incluyen el tratamiento térmico en su preparación (Ramos Jaramillo, 2015).
Extractos de ricino. La disminución del crecimiento de las colonias de Penicillium sp. fue registrada en los tres tratamientos con los extractos de ricino. El extracto Ricino III resultó el más efectivo en la disminución del crecimiento de las colonias del patógeno (Figura 8).
Dicho efecto podría deberse al método de extracción empleado para obtenerlo. A diferencia de los otros tratamientos con ricino, el tratamiento Ricino III se obtuvo por disolución de las semillas prensadas y molidas en agua destila con pH 3,8, con un posterior filtrado simple con algodón. Por lo tanto, el extracto resultante solo estaría compuesto por sustancias hidrosolubles (la ricina es una de ellas). En los tratamientos Ricino I y Ricino II, al realizar pasos de purificación, si bien la pureza de la proteína en cuestión aumenta, su concentración disminuye. Siempre en una purificación se recupera un porcentaje menor de lo existente anteriormente, es decir que con cada paso de purificación se pierde cierta cantidad de la molécula de interés; y como en los tres tratamientos se llevó al mismo volumen final, esto se podría ver como una disminución en la concentración de la ricina. Además, al haber menos contaminantes, es posible que se haya perdido alguna otra molécula con características fungicidas. Por otro lado, se incorporan compuestos como el sulfato de sodio y la acetona, que, a pesar de su utilidad en la purificación de la ricina, en estos ensayos su adición podría haber sido el causante del menor efecto en el control del patógeno.
El análisis estadístico realizado mostró que existen diferencias significativas (p: 0,05) en el diámetro de colonias del patógeno cultivadas en APG más extractos en comparación con el crecimiento del testigo (Penicillium sp. en medio APG sin adición del extracto) (Figura 9). Mientras que, no se encontraron diferencias significativas entre los tres tratamientos con extractos de ricino (Ricino I, Ricino II y Ricino III) transcurridos los siete días de la prueba. Sin embargo, sí cabe destacar la diferencia en el avance del porcentaje de inhibición en cada tratamiento. En la Figura 10 se observa que al día 1 de sembradas las placas tanto Ricino I como Ricino II lograron un porcentaje de inhibición cercano al 60% (63 y 56 % respectivamente) mientras que Ricino III solo el 19%. Al cabo de cinco días, Ricino III logró un porcentaje de inhibición del patógeno del 69%, mientras que Ricino I logró un 61 % y Ricino II un porcentaje de inhibición mucho menor, alcanzando los 54%. Sin embargo, al séptimo día el porcentaje se iguala estadísticamente bajo los tres tratamientos en un valor medio de 52%.
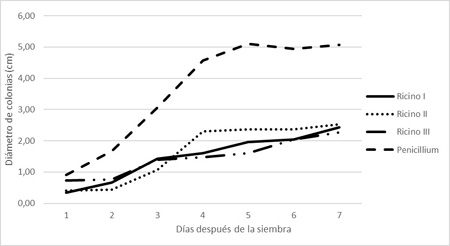
Figura 8. Crecimiento de colonias de Penicillium sp. bajo tres tratamientos (Ricino I, II y III) y el testigo (Penicillium individual).
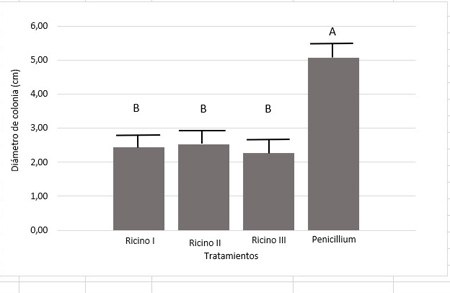
Figura 9. Diámetro de colonias de Penicillum sp. bajo tres tratamientos (Ricino I (A), II (C) y III (B) y el testigo (Penicillium individual).
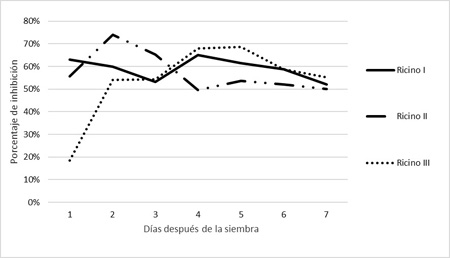
Figura 10. Porcentaje de inhibición de crecimiento de Penicillium sp. en medio APG bajo tres tratamientos.
Pruebas de antagonismo con Trichoderma. Con respecto a los ensayos con T. harzianum, se encontraron diferencias significativas en el crecimiento de las colonias del hongo patógeno Penicillium, en cultivo dual con T. harzianum, en comparación con el testigo (cultivo individual de Penicillium) (Figura 11). T. harzianum generó una disminución del diámetro final de las colonias del patógeno del 87%.
Este porcentaje de disminución del tamaño de las colonias coincide con los numerosos estudios realizados que muestran la capacidad antagónica obtenida con las cepas de Trichoderma, dada su efectividad para inhibir y micoparasitar diferentes hongos filamentosos patógenos de plantas, a través de su actividad fisiológica y bioquímica (Quiroz Sarmiento, et al., 2008; Handelsman y Stabb, 1996; Harman et al., 2004; Vinale et al., 2006)
Quiroz Sarmiento et al. (2008) utilizaron dos cepas de Trichoderma spp. (ST–2 y RP–12b) para probar su efecto antagónico hacia dos cepas de Fusarium spp. (SP–P4 y CH–A3) y Penicillium sp. (CH–A3). Como resultado obtuvieron que el mayor efecto inhibitorio del crecimiento de los tres patógenos fue obtenido cuando se confrontaron las dos cepas de Trichoderma, cuya inhibición osciló del 70 al 100%. La cepa de Trichoderma RP–12b causó el 100% de inhibición del crecimiento de los tres patógenos. En ambos casos, las cepas de Trichoderma mostraron la tendencia hacia el micoparasitismo. Los daños observados fueron la lisis y destrucción de conidióforos y esporas de Penicillium; y la deformación de conidios y lisis de los septos en Fusarium. Quiroz Sarmiento et al. (2008), también mencionan que “estos efectos sobre las estructuras de los patógenos, pueden estar relacionados con la producción de enzimas como quitinasa, β–glucanasa, celulasa y proteasa por parte de las cepas de Trichoderma, y que son un componente importante en el proceso del micoparasitismo” (De la Cruz et al., 1992; Goldman et al., 1994; Harman, 2006).
Por su parte, Vinale et al. (2006) observaron en ensayos in vitro que Trichoderma harziarum raza T22 produce una azafilona (un metabolito secundario policétido) con una marcada inhibición del crecimiento de patógenos como Gaeumannomyces graminis var. tritici, Rhizoctonia solani y Phytium ultimum, resultando en una inhibición total del crecimiento de los mismos con una concentración de 1, 10 y 100 µg respectivamente.
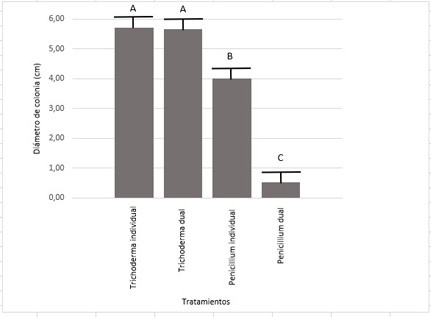
Figura 11. Diámetro de colonias de Penicillium y T. harzianum en cultivo individual y dual
En la Figura 12, se observa como ya al segundo día de sembradas las placas, el crecimiento de las colonias del patógeno se ve inhibido en forma considerable. Esto se debe al antagonismo generado por el hongo T. harzianum.
En cuanto a la dinámica del crecimiento de las colonias de T. harzianum, en cultivo individual, ésta muestra una típica curva de saturación, mientras que en cultivo dual se observa un amesetamiento de la curva a partir del día dos de la prueba, este comportamiento se extiende hasta el día cuatro donde se observa una aceleración progresiva para finalmente alcanzar al séptimo día, el mismo diámetro de colonia que el cultivo individual testigo (Figura 13). No se observaron diferencias estadísticamente significativas en el diámetro de colonias de T. harzianum en cultivo dual en comparación con el cultivo individual del mismo (Figura 11).
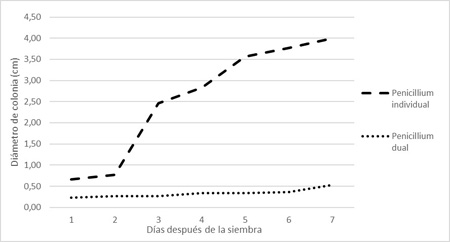
Figura 12. Diámetro de colonias de Penicillium sp. en cultivo dual con T. harzianum e individual (testigo).
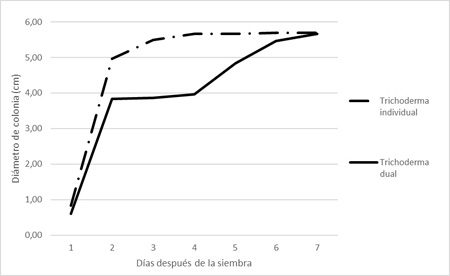
Figura 14. Diámetro de colonias de T. harzianum en cultivo dual con Penicillium sp. e individual
Los resultados alcanzados tanto con los extractos de ricino como con T. harzianum pusieron en evidencia el potencial efecto biocontrolador que dichos tratamientos poseen. Sin embargo, cabe destacar que el uso de T. harzianum alcanzó mejores resultados con respecto al tamaño final de las colonias del patógeno en estudio. El uso de T. harzianum logró una reducción del tamaño del patógeno cercana al 87%, mientras que el tratamiento Ricino III, aquel de mejor comportamiento, logró que las colonias del patógeno se desarrollen un 55% menos con respecto al cultivo individual del mismo.
4. Conclusiones
El uso del aceite de ricino sobre el cultivo de B. cinerea resulta en un potencial estimulador del crecimiento de esclerocios cualquiera sea su concentración. Se encontró que la concentración de mayor respuesta fue la de 350ppm. Es promisorio el uso del mismo como complemento nutritivo al medio de cultivo no, así como un biocontrolador de este hongo debido a los resultados ya expuestos.
El uso de Trichoderma en control biológico de patógenos fúngicos es realmente una alternativa al control químico altamente efectiva, se demostró tanto en el presente trabajo frente al cultivo de Penicillium, como en otros anteriormente mencionados. Sin embargo, no resulta ser la única alternativa, sino que también los diferentes extractos de las semillas de ricino evaluados mostraron efectos positivos en el control de Penicillium.
Estos resultados promisorios resaltan la necesidad de continuar realizando investigaciones con extractos de ricino para lograr la identificación de las sustancias que componen dichos extractos, analizando principalmente el contenido proteico de los mismos, y además poder determinar la toxicidad que presentan frente a otros patógenos.
5. Referencias bibliográficas
Arboleda F., Guzmán O., Mejia L., (2012). Efectos de extractos cetónicos de higuerilla (Ricinus communis) sobre el nematodo barrenador (Radhopolussimilis). Revista Luna Azul, 35: 28-47.
Audi, J., Bolson, M., Patel, M., Schier, J., Osterloh, J. RicinPoisoning: A Comprehensive Review. (2005). JAMA 294(18):2342–2351.
Caffarini P., Pelicano A., Carrizo P., Roggero P., Pacheco J., (2008). Efectos de extractos cetónicos y acuosos de Ricinus communis (ricino), Melia azedarach (paraíso) y Trichillia glauxa (trichillia), sobre la hormiga negra común (Acromyrmex lundi).Idesia (Arica), 26(1): 59-64
Castañeda López, K. J., Contreras Montejo, T. L. (s.f.). Diseño del proceso de extracción de aceite de higuerilla en La Palma (Cundinamarca). Proyecto de grado. Universidad EAFIT. Medellín, Colombia.
Chaves, N., Wang, A. (2004). Combate del moho gris (Botrytis cinerea) de la fresa mediante Gliocladium roseum. Revista Agronomía Costarricense 28(2): 73-85.
Colavino M., Pelicano A., Giménez, R., (2006). Actividad insecticida de Ricinus communis sobre Plodia interpunctella HBN. (Lepidoptera: Phycitinae). Rev. FCA UNCuyo, XXXVIII (1): 13-18
Correa Salgado, M. (2014). Análisis comparativo de características físicas y fitoquímicas del aceite de ricino generado en semillas de ecotipos autóctonos de higuerilla (Ricinus communis), Tungurahua y Manabí (Trabajo de titulación). Universidad Técnica de Ambato.
De la Cruz, J., Hidalgo-Gallego, A., Lora, J M., Benitez, T., Pintor-Toro, J. A., Llobell, A. (1992) Isolation and characterization of three chitinases fromTrichoderma harzianum. Eur. J. Biochem. 206, 859-867
De La Fuente, E. B., Gil, A., Kantolic, A. G., Pereira, M. L., Ploschuk, E. L., Giménez, P. I., Windaer, L,B., (2013). Cultivos Industriales (3a ed.). Buenos Aires: Facultad de Agronomía de la Universidad de Buenos Aires.
Di Rienzo, J.A., Casanaves, F., Balzarini, M., Gonzáles, L., Tablada, M., Robledo. C.W. (2014). InfoStat Versión 2014. Facultad de Ciencias Agropecuarias: Universidad Nacional de Córdoba.
Droby, S., Wisniewski, M., El-, A., Wilson, C. (2002). Biological control of postharvest disease of fruit and vegetables. Currents achievements and future challenges. En: XXVI International Horticultural Congress: Issues and Advances in Postharvest Horticulture. pp. 703-713.
Fraire Cordero, M. L., Yáñez Morales, M. J., Nieto, A. D., Vázquez Gálvez, G. (2003). Hongos patógenos en frutos de fresa (Fragaria x ananassa Duch.) en postcosecha. Revista Mexicana de Fitopatología 21: 285-291.
Goldman, H.G., Hayes, C., Harman, G.E. (1994) Molecular and celular biology of biocontrol by Trichoderma spp. Trends in Biotechnology 12:478–482
Gomes Raffagnato, C., Abadalla de Oliveira Cardoso, T., Vasconcelos Fontes, F., Montez Carpes, M., Cynamon Cohen, S., Americo Calçada, L. (2019). Chemical terrorism: risk modeling proposal for attacks involving ricin in mass gatherings in Brazil. Saúde debate, 43(3): 152-164.
Handelsman, J., Stabb, E. V., (1996). Biocontrol of soilborne plant pathogens. The Plant Cell 8: 1855-1869
Harman, G.E. (2006). Overview of mechanisms and uses of Trichoderma spp. Phytopathology 96:190–194
Harman, G.E., Howell, C.R.,Viterbo, A., Chet, I., Lorito, M., (2004). Trichoderma species opportunistic, avirulent plant symbionts. Nature Reviews Microbiology 2: 43-56
Morales, C. G. (ed.) (2017). Manual de manejo agronómico de la frutilla. Boletín INIA N.º 17. 102 pp.
Murillo, B. G., Guerrero, E. E. F., Zapata, S. R. (2016). Manejo ecológico en frutilla aplicando Trichoderma sp como promotor de crecimiento y controlador biologico de Botrytis cinerea. Avances en energias renovables y medio ambiente. 20: 09.37-09.44.
Murray, R., Candan, A. P., Vázquez, D. (eds.) (2019). Manual de poscosecha de frutas: manejo integrado de patogenos. 2da edicion revisada. Buenos Aires: INTA ediciones
National Center for Biotechnology Information (2021). PubChem Compound Summary for CID 10666, Ricinine. Recuperado de: https://pubchem.ncbi.nlm.nih.gov/compound/Ricinine.
Pacheco Sánchez, C., Villa Ayala, P., Montes-Belmont, R., Figueroa-Brito, R., Jiménez-Pérez, A., (2009). Repellency of hidroethanolic extracts of Ricinus communis (Euphorbiaceae) to Scyphophorus acupunctatus (Coleoptera: Curculionidae). I. J. Appl. Sci. Techh.,2:83-94.
Quiroz-Sarmiento, V. F., Ferrera-Cerrato, R., Alarcón, A., Lara Hernández, M. E. (2008). Antagonismo in vitro de cepas de Aspergillus y Trichoderma hacia hongos filamentosos que afectan al cultivo del ajo. Revista mexicana de Micología, 26: 27-34.
Ramos Jaramillo, E. G. (2014) Obtención de un insecticida biológico a partir de la higuerilla (Ricinus communis) (Trabajo de titulación). Universidad técnica de Machala.
Rodríguez Arias, D. E., Duque Nieto, J. S. (2010). Plan de negocios para el cultivo de higuerilla, estudio de caso municipio de Balboa (Risaralda). Universidad Tecnológica de Pereira, Facultad de Ciencias Ambientales.
Pita, R., Anandón, A., Martinez-Larrañaga, M. R. (2004). Ricina: una fitotoxina potencial de uso potencial como arma. Rev. Toxicol. 21: 51-63.
Sayegh Ordoñez, A. N, Cárdenas Arias, L. G. (2011). Plan de empresa basado en el uso de aceite de higuerilla para la industria cosmetica. Tesis de Maestría, Universidad ICESI
Schieltz, D. M., McGrath, S. C., McWilliams, L. G., Rees, J., Bowen, M. D., Kools, J. J., Dauphin, L. A., Gomez-Saladín, E., Newton, B. N., Stang, H. L., Vick, M J., Thomas, J., Pirkle, J. L., Barr, J. R, (2010). Analysis of active ricin and castor bean proteins in a ricin preparation, castor bean extract, and surface swabs from a public health investigation. Forensic Science International 209 (201 1) 70-79.
Sivakumar, D., Bautista Baños, S. (2014). A review of the use of essential oils for postharvest decay control and maintenance of fruits quality during storage. Crop Protection: 64-27
Tabio García, D., Díaz Domínguez, Y., Rondón Macias, M., Fernández Santana, E., Piloto-Rodríguez, R. (2017). Extracción de aceites de origen vegetal. Universidad Tecnológica de La Habana.
Tripathi, P.; Shulka, A.K. (2007). Emerging non-conventional technologies for control of post harvest diseases of perishables. Fresh Produce, 1:111-120.
Undurraga, P, Vargas S. (eds.). (2013). Manual de frutilla. Boletín INIA N° 262. 112 p.
Vinale, F., Marra, R., Scala, F., Ghisalberti, E.L., Lorito M., Sivasithamparam. K., (2006). Major secondary metabolites produced by two commercial Trichoderma strains active against different phytopathogens. Letters in Applied Microbiology 43: 143-148.
Worbs, S., Kohler K., Pauly, D., Avondet, M., Schaer, M., Dorner, M., Dorner, B. (2011). Ricinus communis Intoxications in Human and Veterinary Medicine – A Sumary of real cases. Toxins. 1332-1372.
Yang, K. S., Triplett, R., Klos, K. S., Waller, G. R. (1965). Chemical Synthesis of Carbon-14 Labeled Ricinine and Biosynthesis of Ricinine in Ricinus communis L. Oklahoma State University, Agricultural Experiment Station.
Enlaces de Referencia
- Por el momento, no existen enlaces de referencia
La Revista Científica y Técnica Agropecuaria, Agroindustrial y Ambiental es una revista en formato digital fundada en el año 2021. Anteriormente denominada Revista de Divulgación Técnica, Agropecuaria, Agroindustrial y Ambiental. Se publican tres números al año en los meses de junio, octubre y febrero.
Órgano Editor: Secretaría de Investigación, Facultad de Ciencias Agrarias, Universidad Nacional de Lomas de Zamora
E mail: revistafca@agrarias.unlz.edu.ar
Teléfono: +54 11 2078 -0500
Dirección: Camino de Cintura y Juan XXIII, Lomas de Zamora, BA, Argentina
 Revista Científica y Técnica Agropecuaria, Agroindustrial y Ambiental
Revista Científica y Técnica Agropecuaria, Agroindustrial y Ambiental


